La configuracion electrónica del carbono es la siguiente: 1s22s22p2
¿Cuántos enlaces puede formar el carbono? ¿De qué tipo?
El carbono (C) aparece en la segunda hilera de la tabla periódica y tiene cuatro electrones de enlace en su envoltura de valencia. Al igual que otros no metales, el carbono necesita ocho electrones para completar su envoltura de valencia. Por consiguiente, el carbono forma cuatro enlaces con otros átomos (cada enlace representa a uno de los electrones de carbono y uno de los electrones del átomo que se enlazan). Cada valencia de electrón participa en el enlace, por consiguiente el enlace del átomo de carbono se distribuirá parejamente sobre la superficie del átomo. Estos enlaces forman un tetradrón (una pirámide con una punta en la partesuperior), como se ilustra en el siguiente dibujo:
| |
El carbono forma 4 enlaces |
Los químicos orgánicos toman su diversidad de muchas diferentes maneras en las que el carbono puede enlazarse con otros átomos. Los químicos orgánicos más simples, llamados hidrocarbonos, contienen sólo carbono y átomos de hidrógeno; el hidrocarbóno más simple (llamado metano contiene un sólo átomo de carbono enlazado a cuatro átomos de hidrógeno:
| |
Metano- un átomo de carbonoenlazado a 4 átomos dehidrógenos |
Pero el carbono puede enlazarse con otros átomos de carbono adicionalmente al hidrógeno tal como se ilustra en el siguiente dibujo de la molécula etano:
| |
Etano- un enlace carbono-carbono |
cadenas en rama:
| |
Hexano- una cadena de 6 carbonos |
cadenas en rama:
| |
Isohéxano- una cadena en ramas de carbono |
anillos:
| |
Cycloéxano- un hidrocarbono en forma de anillo |
Parece ser que no hay límites al número de estructuras diferentes que el carbono puede formar. Para añadirle complejidad a la química orgánica, átomos de carbono vecinos pueden formar enlaces dobles o triples adicionalmente a los enlaces de carbono-carbono:
 | ||
Enlace sencillo | Enlace doble | Enlace triple |
Recuerde que cada átomo de carbono forma cuatro enlaces. A medida que el número de enlaces entre cualquiera de dos átomos de carbono aumenta, el número de átomos de hidrógeno en la molécula disminuye.
¿Cuáles son las características o propiedades de los compuestos orgánicos?
Características de los compuestos organicos:
- Son Combustibles
- Poco Densos
- Electro conductores
- Poco Hidrosolubles
- Pueden ser de origen natural u origen sintético
¿Cómo se representan los compuestos orgánicos? ¿Qué tipo de fórmulas se utilizan?
La fórmula química es la forma escrita de una molécula. Debe proporcionar, como mínimo, dos informaciones importantes: qué elementos forman el compuesto y en qué proporción se encuentran dichos elementos en el mismo.
La fórmula puede ser:
Es la fórmula más simple posible. Indica qué elementos forman la molécula y en qué proporción están. Es la fórmula que se obtiene a partir de la composición centesimal de un compuesto. Por ejemplo, si tenemos un hidrocarburo (formado por H y C) podemos combustionarlo en presencia de oxígeno, y a partir del CO2 y H2O que se forman determinar la cantidad de C e H que contiene. Bastará calcular los moles de C e H, y dividir estas dos cantidades por el valor más pequeño determinando la proporción de los átomos en el compuesto, es decir, su fórmula empírica.
Ejemplo : CH, compuesto formado por carbono e hidrógeno, en la proporción: 1 a 1.
Indica el número total de átomos de cada elemento en la molécula. Para conocer la fórmula molecular a partir de la empírica es preciso conocer la masa molecular del compuesto. A partir de las propiedades coligativas, como presión osmótica, descenso crioscópico o aumento ebulloscópico, podemos determinar la masa molecular, y a partir de ésta la fórmula molecular con una simple proporción.
Hay tres formas distintas de escribir una fórmula molecular:
| Condensada | Expresa el tipo y número de átomos de la molécula. Pero no informa de los enlaces que presenta la misma. | Ejemplo: C6H6 compuesto formado por seis átomos de carbono y seis átomos de hidrógeno. |
| Semidesarrollada | En ella se representa sólo los enlaces carbono-carbono. | Ejemplo: HC º CH presenta un enlace triple carbono-carbono. |
| Desarrollada o Estructural | Se representan todos los enlaces de la molécula. | Ejemplo: H - C º C - H En la mayor parte de los casos bastará con la fórmula semidesarrollada. |
Geométricas:
Abrevian la escritura e indican la distribución de los átomos en el plano o en el espacio.
| Planas | |
| Tridimensionales | 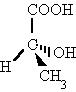 Las cuñas y líneas discontinuas pretenden ayudar a dar perspectiva a la molécula. COOH y H están en el plano.OH está detrás del plano. CH3 está delante del plano. Las cuñas y líneas discontinuas pretenden ayudar a dar perspectiva a la molécula. COOH y H están en el plano.OH está detrás del plano. CH3 está delante del plano. |





No hay comentarios:
Publicar un comentario